拓达维在中国获批 用于转移性三阴性乳腺癌二线治疗
中国网财经6月10日讯(记者 杜丁)今日,云顶新耀宣布国家药监局(NMPA)已批准拓达维(英文商品名Trodelvy ,戈沙妥珠单抗)用于既往至少接受过2种系统治疗(其中至少一种治疗针对转移性疾病)的不可切除的局部晚期或转移性三阴性乳腺癌成人患者。
据了解,拓达维是云顶新耀获准在中国上市的首款创新药品,也是全球首个且唯一获批的靶向Trop-2的ADC药物,国家药监局于2021年5月接受其生物制品上市许可申请并授予优先审评。云顶新耀首席商务官郭永表示,拓达维预计将在今年第四季度正式商业化上市。
三阴性乳腺癌指癌组织免疫组织化学检查结果为雌激素受体(ER)、孕激素受体(PR)和原癌基因HER2均为阴性的乳腺癌,是一种高度侵袭性疾病,约占全球所有乳腺癌类型的15%。三阴性乳腺癌转移复发的平均时间约为2.6年,而其他乳腺癌为5年,相对的5年生存率更低。在转移性三阴性乳腺癌女性患者中,5年生存率为12%,而其他类型转移性乳腺癌患者的5年生存率为28%。
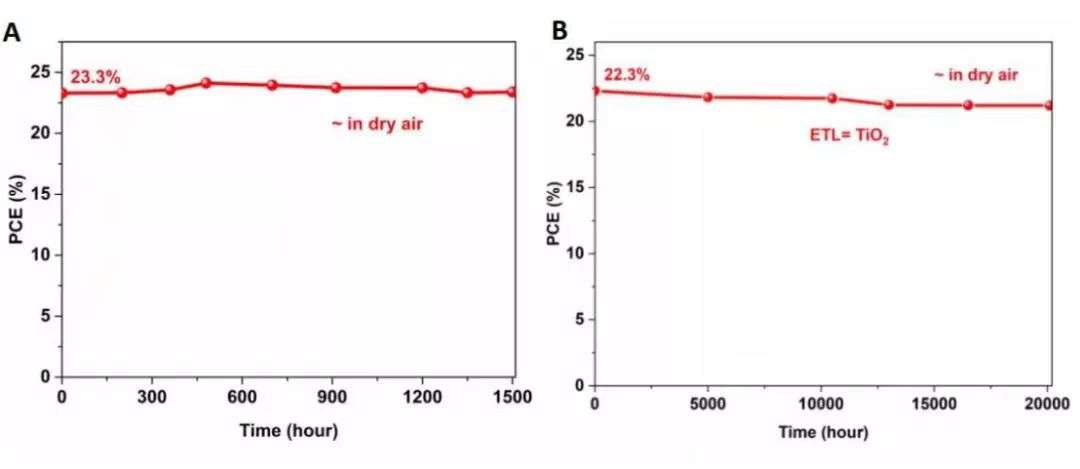
2021年11月,云顶新耀公布了戈沙妥珠单抗2b期EVER-132-001研究的顶线结果,该研究以38.8%的客观缓解率(ORR)达到其主要终点。这项研究在中国的80名患者中开展,所得结果与全球3期ASCENT研究的结果一致,因此显示其在中国人群中具有相似的疗效和安全性。
“三阴性乳腺癌患者临床上急需新的有效治疗方案。我目睹了戈沙妥珠单抗,即拓达维引进到中国的全过程,并牵头开展了在中国的注册性临床研究。很高兴戈沙妥珠单抗在国内临床研究与国际上一样均展现了良好的治疗效果,作为临床医生,我们期待这款新药尽早应用到临床,拯救更多患者的生命。”中国工程院院士、国家新药(抗肿瘤)临床研究中心主任、拓达维中国注册研究主要研究者徐兵河教授表示。
根据与吉利德科学公司签署的授权协议,云顶新耀在中国、韩国和部分东南亚国家享有针对拓达维(Trodelvy)所有癌症适应症开发、注册和商业化的独家权利。除了已批准拓达维的中国大陆和新加坡外,云顶新耀正在与韩国、中国台湾地区和香港地区的药品监管部门紧密配合,推进药物的获批上市。此外,包括激素受体阳性/人表皮生长因子受体2阴性(HR+/ HER2-)转移性乳腺癌、转移性非小细胞肺癌(NSCLC)、转移性小细胞肺癌(SCLC)、头颈癌和子宫内膜癌等多个适应症正在开发中。