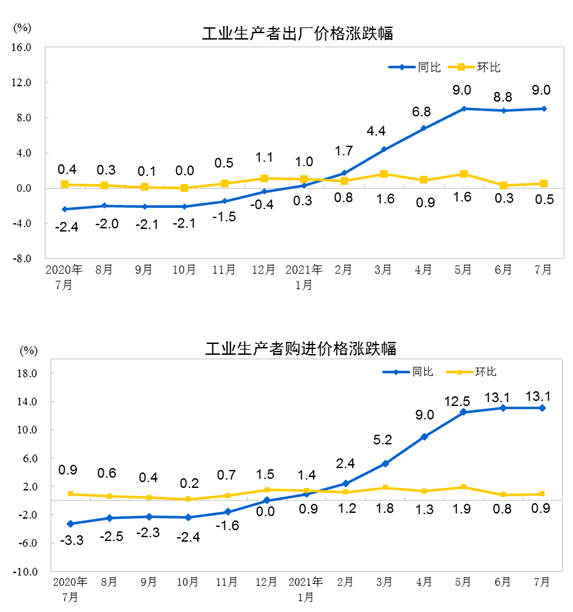
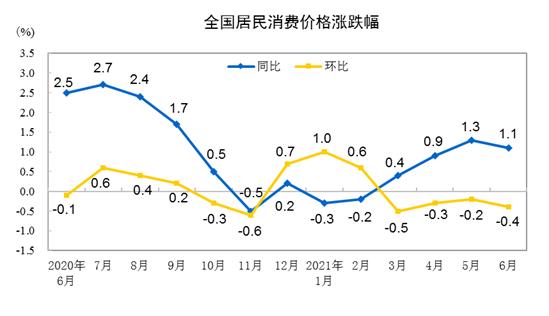
医疗器械临床试验机构备案制点燃临床热情
距离2018年1月1日《医疗器械临床试验机构条件和备案管理办法》(以下简称《备案办法》)正式实施仅17天,第一个备案号“械临机构备201800001”悄然发放,珠海市人民医院成为首家备案成功的医疗器械临床试验机构。
截至记者发稿,国家食品药品监管总局“医疗器械临床试验机构备案管理信息系统”(以下简称“备案系统”)公布的备案机构已有16家。是什么动力促使这些医疗机构对“备案制”快速反应?备案资料的填报有哪些注意事项?各界对推动《备案办法》的落地又有哪些意见建议?带着这些问题,记者采访了相关医疗机构。
程序明确告知备案
打开国家食药监总局的官方网站,在“网上办事”栏目下进入备案系统,可以看到备案机构一览表,16家备案机构所在的省份、备案号、机构名称、地址、联系人、联系方式等一览无余。点击表格最后一列“查看详情”,备案机构的级别、备案时间、备案专业、主要研究者及其职称等信息均被详细列出。目前在已备案的16家医疗机构中,全部为三级医院。
“去年,《备案办法》一发布,我们医院就开始准备申报材料。今年1月1号备案管理信息系统开通后,我们便按照要求进行申报,获得了首个备案号。我们自己也没想到会成为第一家完成备案的单位。”珠海市人民医院备案工作联系人肖静如是说。事后,肖静陆续接到其他多家医疗机构的电话,咨询有关备案信息申报的操作流程和注意事项等。
国家食药监总局食品药品审核查验中心研究检查处副处长王佳楠介绍,此次对医疗器械临床试验机构的备案管理属于“告知性备案”——医疗机构登陆“医疗器械临床试验机构备案管理信息系统”填写注册信息后,只需要邮寄“资料符合性声明”到审核查验中心,经确认信息无误后,医疗机构就会收到注册成功的邮件通知。之后可以登录备案系统,填写备案资料。
“由于注册时还没有生成账号,所以无法保存,如果注册信息填写一半时退出页面,再登录时还得从头填写。因此,一定要按照上传附件资料中列出的清单,先把资料准备完整,再开始填报。”王佳楠提醒。
针对医疗机构咨询较集中的问题,审核查验中心已经梳理成“医疗器械临床试验机构备案管理信息系统常见问题”,在备案系统中统一解答。需要邮寄哪些资料,邮寄到哪里,寄出后多久能收到结果,机构名称是否可以输入括号等细节问题,都可以从备案系统中找到答案。
释放资源满足需求
推行医疗器械临床试验机构备案制,初衷是激发医疗机构的积极性,增加临床试验机构的数量,满足医疗器械临床试验需求,对鼓励医疗器械产品创新、促进医疗器械产业健康发展具有重要意义。那么,医疗机构参与器械临床试验的动力何在?治病救人和参与临床试验工作之间是否存在矛盾?已经备案的医疗机构给出了他们的答案。
“《备案办法》发布后,我们立即组织了37个专业科室学习,对政策进行解读,要求各科室在2017年12月15日前提交相关申报资料。从反馈情况来看,各科室对医疗器械临床试验有较高热情,共有20个专业参与了备案。”成都市妇女儿童中心医院药品临床试验管理规范办公室主任徐鸣说。
厦门市妇幼保健院副院长周裕林表示:“我们愿意承接医疗器械临床试验主要有四方面的考虑:一是为医务人员提供参与临床试验的科研机会;二是扩大医院的学术影响力和学科水平;三是让自愿参加临床试验的患者更早地使用上新型医疗器械;四是为创新性医疗器械产品提供科学验证。”
作为我国人工生物角膜领域的领军人物,华中科技大学同济医学院附属协和医院眼科主任张明昌介绍:“我国至少有400万因各种角膜疾病而致盲的患者,但每年仅5000名患者可成功进行角膜移植,很多医院和眼库都是等米下锅状态。尽快开展人工生物角膜产品临床试验,对于优化产品、满足临床需求具有重要意义。”
清华大学附属北京清华长庚医院临床试验管理人员介绍,此次该院申报专业40余个,从获得备案号到现在,已有8项临床试验受到临床试验申办方或合同研究组织的关注。目前,这些项目正在接洽中。
肖静也告诉记者:“临床试验机构备案成功后,打电话向我们咨询的医疗器械临床试验申办方明显增多了。下一步,我们还会继续申报新的专业。”
建言献策保障落地
为保证临床试验工作的持续开展,妥善安排好过渡期工作,《备案办法》规定,2018年1月1日——2018年12月31日,医疗器械临床试验申办者可以继续选择经国家食药监总局会同国家卫生计生委认定的药物临床试验机构开展临床试验。但自2019年1月1日起,医疗器械(包括体外诊断试剂)临床试验申办者应当选取已经在备案系统备案的医疗器械临床试验机构,按照《医疗器械临床试验质量管理规范》和《体外诊断试剂注册管理办法》有关要求开展临床试验。
如何吸引更多的医疗机构参与医疗器械临床试验?医疗器械企业对临床试验管理又有哪些建议和要求?备案制落地过程中,还有哪些工作需要细化和完善?医疗机构和企业也提出了自己的考虑和建议。
现阶段,医疗机构比较关心伦理审查和知情同意的具体操作。厦门市妇幼保健院医学检验科副主任叶辉铭博士表示:“像体外诊断试剂的伦理审查,如果按照药物临床试验的标准要求,会牵扯临床试验机构大量的精力。建议对不涉及患者隐私,未增加患者费用,无须多采集血样的临床试验,适当放宽伦理审查的要求。”该院药学部主任陈瑶则表示,对于体外诊断试剂临床试验使用的血样,患者的知情同意要谈到什么程度,知情同意书的模板有没有,都需要有更细化的指导意见。
此外,医疗机构还希望得到一定的鼓励政策。“对于医疗机构或临床专家,根据试验的创新性和难度大小,能否在经费补贴、学术成果认定等方面给予一定奖励?同时,希望国家食药监总局组织培训班,能下沉到省级医疗机构,指导我们规范开展医疗器械临床试验。”周裕林说。
按照《备案办法》,青岛中皓生物工程有限公司选择华中科技大学同济医学院附属协和医院眼科作为组长单位,已成功开展人工生物角膜的临床试验。“我赞成对医疗器械临床试验实行备案管理,严格监控,提高试验质量。”公司董事长王宝泉坦言,企业在选择临床试验机构时,非常看重牵头专家的水平。随着《备案办法》的“落地”,未来医疗器械临床试验机构数量和水平都将大幅提升,这也为企业提供了更多的选择空间。
王宝泉还提出,企业要选派临床试验监察员全程监察,并定期与临床试验机构的专家沟通。当前,既懂医疗器械技术,又懂临床试验程序的监察员十分紧缺,希望国家食药监总局能组织更多的针对企业医疗器械监察员的培训,给予统一权威的指导。