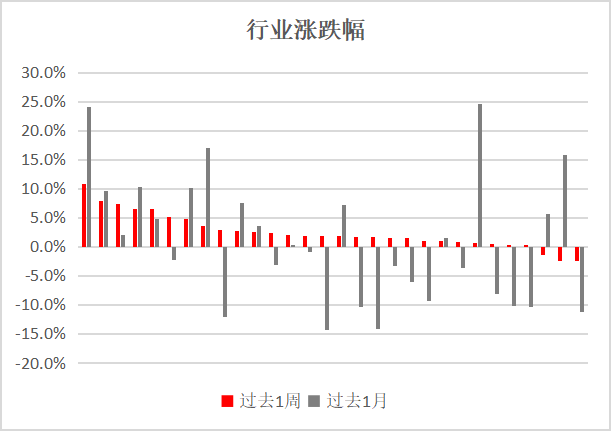
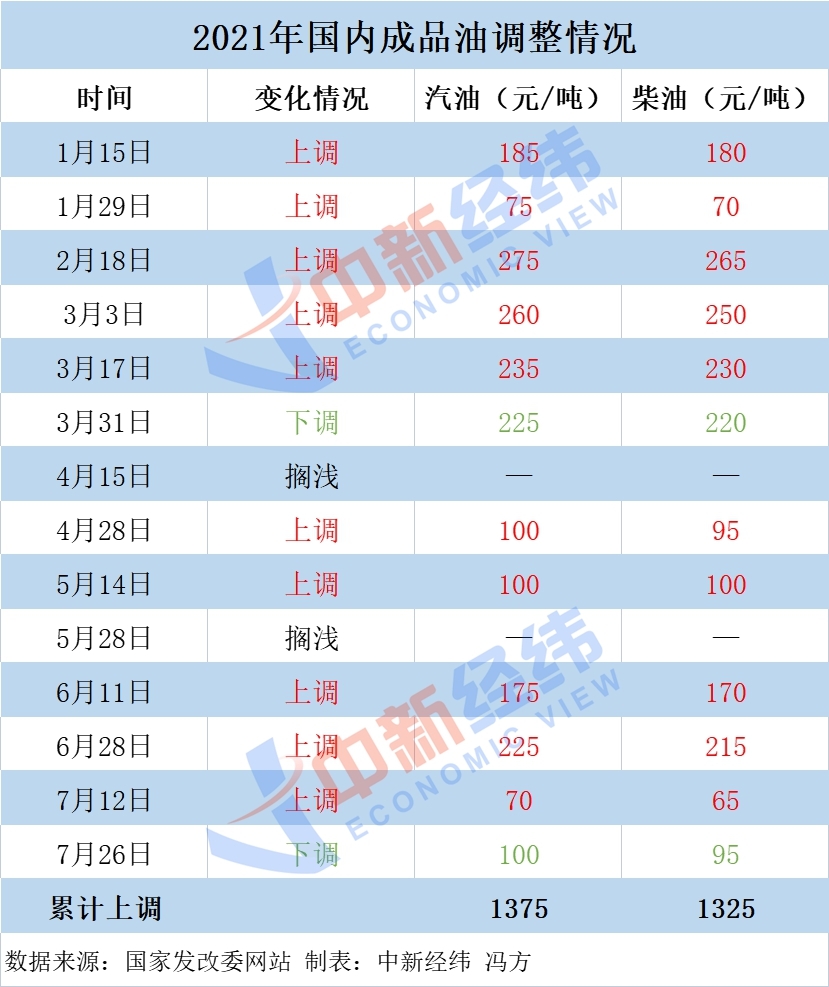
医疗保健行业投资报告:药品注册制度再突破
2016年7月7日,CFDA发布《做好药品上市许可持有人制度试点有关工作的通知》,此前国务院《关于改革药品医疗器械审评审批制度的意见》、人大《关于授权国务院在部分地方开展药品上市许可持有人制度试点和有关问题的决定》、国务院《药品上市许可持有人制度试点方案》已相继出台,此次CFDA进一步细化了MAH试点工作的有关事项。
利于研究成果转化,鼓励创新:以往的药品注册制度下,药品批准文号与生产企业绑定在一起,研发机构需要建设厂房或者进行技术转让,限制了研发机构或研发人员的成果转化以及药品的进一步改善;在MAH试点的10个省份内的药品研发机构与研发人员可申请药物临床试验与药品上市,上市获批并取得药品批准文号的,可成为药品上市许可持有人,不具备生产资质的持有人,可委托试点区域内的企业生产,有利于研究成果的转化,促进了专业的分工。
减少重复建设,优化资源配置:当前的药品生产企业重复建设严重,部分药品具有众多生产批文,MAH试点推行后,持有人作为责任主体,可自行生产或者委托有限数量的企业生产,试点区域内的重复建设将大大减少。只要在试点区域的10个省份内,持有人可自由委托具有资质的企业进行生产,有利于资源的优化配置。
明确持有人的主体责任,有利于促进药品研发与生产规范化:持有人须在药品的整个周期内承担责任,包括临床、注册、生产、流通、检测与评价、质量追溯、信息公开等方面;委托企业进行生产的,持有人负责督促生产企业按照GMP的规范进行生产,其他义务也可与生产进行约定,但最终责任仍由持有人承担。持有人在研发、生产与销售阶段对质量管理与合作方的选择上将更加慎重,有利于促进研发的规范化与药品质量的提升。
利好研发型企业,建议关注创新药企与CRO、CMO公司:对于创新药企以及CRO、CMO公司,可充分利用自身研发优势,借助MAH制度将研究成果加以转化,建议关注恒瑞医药、人福医药、泰格医药、博济医药、ST百花。