药品医械审批改革意见出炉 鼓励创新与仿制
“这个文件的主题就是鼓励创新,着力点就是要解决公众用药的问题,让公众能用得上新药,用得上好药。”10月9日,国家食品药品监督管理总局副局长吴浈在《药品医疗器械审评审批改革创新意见》新闻发布会说道。
近日,针对当前药品医疗器械创新面临的突出问题,中共中央办公厅、国务院办公厅印发了《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》(以下简称“《意见》”),内容包括改革临床试验管理、加快上市审评审批、促进药品创新和仿制药发展等六方面共36条具体措施的改革。其中相关措施将大大提高审评审批效率,鼓励我国药品医疗器械创新研究。但同时,注射剂药品将面临更严峻的审批政策。
山东新华医疗器械股份有限公司质量部负责人向《中国经营报》记者表示,其中相关措施的出台,对于医疗器械生产企业是非常大的利好消息,其产品注册上市至少节约两个月的周期。
多手段提高审批速度
早在2015年8月,国务院印发的《关于改革药品医疗器械审评审批制度的意见》中就提出,2016年底前消化注册申请积压存量,2018年实现按规定时限审批,建立更科学、高效的审评审批体系。
如今,改革已经取得了阶段性的成果。吴浈表示,目前我国药品注册申请的积压问题基本解决,国内医药创新的氛围日渐浓厚,企业科研投入明显增加。尽管如此,我国药品审评审批制度仍有不尽合理之处。
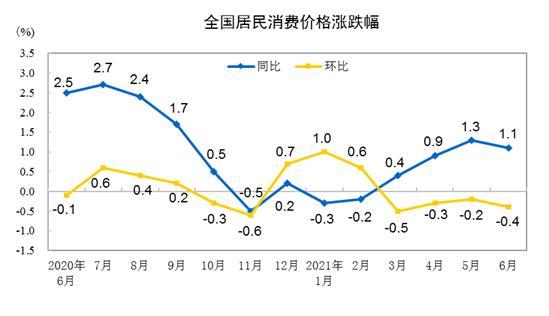
据统计,2001年至2016年,发达国家批准上市的创新新药有433种,而在中国上市的只有一百多种,仅占30%。近十年来,我国上市的一些典型新药,上市时间平均比欧美国家晚5~7年。甚至催生了个人从境外携带药品的现象。
面对这种现状,《意见》提出多项措施加快审评审批速度。例如,在境外多中心取得的临床试验数据,符合中国药品医疗器械注册相关要求的,可用于在中国申报注册申请。另外,《意见》对罕见病用药和器械、临床急需药开辟了特别通道,可以附带条件批准上市。
除接受境外数据和上市产品,更多的临床试验管理改革措施旨在鼓励增加临床试验机构数量及提高临床试验机构的效率。其中临床试验机构资格认定制改为备案制是改革的一项重要举措。即具备临床试验条件的机构在食品药品监管部门指定网站登记备案后,可接受药品医疗器械注册申请人委托开展临床试验。
食药监总局药品化妆品注册管理司司长王立丰表示,改革将针对机构的认定改为围绕试验药物全过程检查,使临床试验监管的针对性更加明确、清晰,将监管的重心由认定机构的形式转为监督检查机构开展临床试验能力的形式,“唯能力而不唯机构”。
新华医疗质量部负责人对此表示,临床研究中心取消审批改为备案,意味着更多医院可以加入到临床试验的大队伍中,并将社会办临床机构纳入合法条文,这给医疗器械生产企业提供了一个更为广阔的选择机会,但对主研提出了明确的资质要求。
同时鼓励创新与仿制
高效率审批之下,创新药品医疗器械将更快走进中国,而国内企业研发工作同样需要政策推动。
“国内制药企业数量比较多,但是制药企业新产品研发总投入只有全球最大的制药公司一家的投入量,这就是研发投入不够。”发布会上,吴浈还对我国药品医疗器械创新面临的深层次问题进行了具体剖析。
因此,《意见》中多项举措意在鼓励创新产品知识产权保护,要求探索建立药品审评审批与药品专利链接制度、开展药品专利期补偿的试点、完善和落实数据保护制度。“这三者合在一起,是知识产权保护的组合拳,将有效保护专利权人的合法权益,激发创新活力。”吴浈表示。
值得一提的是,《意见》在鼓励创新的同时也鼓励仿制。
“我们鼓励创新,也鼓励仿制,这套制度将起到很大的效果。该保护的要保护,保护时间一到,仿制药就上市,形成断崖式的价格下降,这样为临床用药可及奠定了基础。”吴浈表示,药品知识产权保护的系列措施,完全符合我们国家建设创新型国家和促进医药产业创新发展的需求,对保护和激发我国正在蓬勃发展的民族医药创新活力,尤其是对我国特有的具有独立自主知识产权的中药领域,将会发挥极大的积极作用。
注射制剂上市审批趋严
在医药行业整体释放利好信号的同时,药品安全有效性也备受关注,一些细分行业面临着挑战。
《意见》第十一条剑指药品注射剂上市把控问题。其要求,口服制剂能够满足临床需求的,不批准注射制剂上市;肌肉注射制剂能够满足临床需求的,不批准静脉注射制剂上市;不同剂型注射剂间无明显临床优势的,不予批准互改剂型。
注射剂当中,备受关注的是中药注射剂。食药监总局发布的药品不良反应监测年度报告显示,2016年,中药不良反应事件报告中,中药注射剂占比53.7%,同比上升2.4%。而9月23日食药监总局关于出现不良反应批次的喜炎平、红花注射液的召回通告也引发了业内对中药注射剂安全性的讨论。
近年来,中药注射剂的安全性问题也引起了国家重视。在今年年初人社部发布的2017版国家医保目录中,37个中药注射剂限用于二级及以上医疗机构,并且限用于重症,限用占比高达82.22%。
“注射剂中大家最关心的就是中国特有的中药注射剂。在我国缺医少药的年代,中药注射剂起到了很好的作用。但中药注射剂的一个缺陷就是在那个年代临床有效性数据、安全性数据都不太全,为此引发了大家对于中药注射剂的安全性的担忧。”吴浈表示,一直在密切观察中药注射剂的安全性,凡是出现不良反应都会采取果断的措施,目的是最大限度保护公众用药安全。
除严格控制注射剂产品上市审评审批,已经上市的注射剂产品还要面临再评价,力争5至10年基本完成。通过再评价的,享受仿制药质量和疗效一致性评价的相关鼓励政策。吴浈表示,注射剂的再评价和仿制药一致性评价目的是相同的,即提高药品质量。