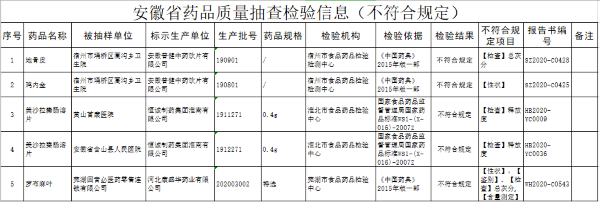
国家规范罕见病诊疗、保障罕见病患者用药的步伐不断加快
2019年2月28日是第12个国际罕见病日。在当天召开的“2019国际罕见病日北京发布会&研讨会”上,与会专家提出,如何打破市场失灵,激励企业为少数患者提供和生产药品,同时还能获利并可持续发展,是罕见病领域特有的挑战。将罕见病纳入公共治理范畴,建立罕见病医疗保障体系,不仅能保障患者权益,还有利于激励产业创新增强市场活力。
政策关怀
瓷娃娃、蝴蝶宝贝、月亮的孩子……这些听来美妙实则忧伤的词,代表着一个个罕见病种。在我国,约有2000万患者在与罕见病作斗争。2018年5月,国家五部委联合公布了《第一批罕见病目录》,收录了121种罕见病。这是中国政府首次以病目录的形式界定何为罕见病。2019年2月15日,国家卫生健康委办公厅宣布建立“全国罕见病诊疗协作网”,以加强我国罕见病管理,提高罕见病诊疗水平,维护罕见病患者健康权益。
日前召开的国务院常务会议决定,从3月1日起,对首批21个罕见病药品和4个原料药,参照抗癌药对进口环节减按3%征收增值税,国内环节可选择按3%简易办法计征增值税。
从鼓励罕见病用药研发列入规划,到《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》等文件出台支持罕见病药品研发上市,再到颁布第一批罕见病目录、成立罕见病联盟、组建罕见病诊疗协作网,国家规范罕见病诊疗、保障罕见病患者用药的步伐不断加快。
一把金钥匙
目前我国罕见病药品主要依赖进口和仿制。由于罕见病的复杂性,单个疾病病人少、回报低、研发周期长、风险大,国内多数药企未涉足相关领域。不过,观察美国罕见病药物市场表现,可以发现罕见病药物或是一把打开市场的金钥匙。
IQVIA全球药品终端销售数据显示,在美国,罕见病药物市场规模在过去的二十年间发展迅速,其中非罕见病适应症的销售贡献远超罕见病适应症。罕见病药物(俗称“孤儿药”)身份认定及适应症的获批,带动了其在常见病适应症的拓展。
据制药公司公开财务报告统计,2018年全球市场销售金额排名前10的药物中,有8个已在美国获得“孤儿药”身份认定,其中有4个药物是以“孤儿药”身份上市并逐渐扩展多个罕见病或非罕见病适应症。如全球销售排名第二的来那度胺,在美国获批的所有适应症,都是罕见病且获得了“孤儿药”身份认定。
IQVIA中国区副总裁邵文斌表示,全球医药市场上的重磅药物都曾受益于“孤儿药”身份认定带来的市场准入利好条件。罕见病,并非孤立的医学领域,对罕见病药物的研发和生产,并非局限于小众市场,建立罕见病医疗保障体系,更是有助于营造鼓励创新的行业环境,最终促进整个生物医药行业的创新发展。
2018年,治疗血友病、视网膜母细胞瘤、特发性肺动脉高压、法布雷病等罕见病的多个药物通过了国家药监局的快速审评审批,已申请上市。其中,包括远大医药的卡谷氨酸,西安力邦的美法仑,博雅生物、振兴生化子公司广州双林生物的人凝血因子VII,兆科药业的苯丁酸钠散等药品。
此外,由于罕见病80%是遗传性疾病,针对罕见病的基因检测也已有多家公司在布局,如华大基因、贝瑞基因、明码生物等。据行业人士介绍,基因检测真正应用到罕见病中,需要跨越的壁垒依然很多。目前除无创产前筛查基因检测已基本进入成熟阶段外,其余临床级基因检测产品,如肿瘤诊断与治疗、遗传病诊断等,还在试点中,需要更完善的行业标准的建立。