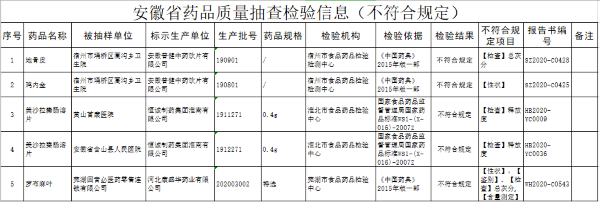
化工行业:射剂一致性评价落地 仿制药市场再临变局
事件:
2020年5月14日,国家药监局发布《关于开展化学药品注射剂仿制药质量和疗效一致性评价工作的公告》。同时 CDE 经国家药品监督管理局审核同意,发布了《化学药品注射剂仿制药质量和疗效一致性评价技术要求》《化学药品注射剂仿制药质量和疗效一致性评价申报资料要求》《化学药品注射剂(特殊注射剂)仿制药质量和疗效一致性评价技术要求》三个配套文件。
参与品种和审评时限:
参与品种和相关要求:已上市的化学药品注射剂仿制药,未按照与原研药品质量和疗效一致原则审批的品种均需开展一致性评价。药品上市许可持有人应当依据国家药品监督管理局发布的《仿制药参比制剂目录》选择参比制剂,并开展一致性评价研发申报。特殊注射剂(如脂质体、静脉乳、微球、混悬型注射剂、油溶液、胶束等)还需根据特殊注射剂的特点,参照 FDA、EMA 发布的特殊制剂相关技术要求,科学设计试验。氯化钠注射液、葡萄糖注射液、葡萄糖氯化钠注射液、注射用水、部分放射性药物(如锝〔99mTc〕)等品种无需开展一致性评价,需进行质量提升研究,灭菌工艺、滤器与包材选择(含相容性研究)等应符合相关技术要求。
一致性评价审评时限:依据《关于仿制药质量和疗效一致性评价工作有关事项的公告》(2017 年第 100 号),审评工作应当在受理后 120日内完成。经审评认为需申请人补充资料的,申请人应在 4 个月内一次性完成补充资料。发补时限不计入审评时限。
投资要点:
化药注射剂市场规模大,预计延续口服制剂改革思路
我国化药市场规模达数千亿元,并且注射剂占据了过半的市场份额。我们认为:与口服制剂相一致的是,注射剂一致性评价一方面将进一步加强对化学药品注射剂仿制药质量和疗效的评价;另一方面,注射剂一致性评价仍将作为注射剂产品“集中采购”的开端和发起点。在口服制剂带量采购有序推进的节点,注射剂一致性评价将进一步完成药物支付端体系的变革,进一步延续“提高质量,鼓励创新”的基本思路。
市场格局是重要影响因素,部分领域预计将竞争激烈
参考过去口服制剂的集中采购要求,集采品种遴选标准为过评企业数超过 3 家,目前有超过 50 个品种申报企业大于或等于三家,多为呼吸类、消化类、抗感染类用药。
共线产品享受政策红利
国内药品生产企业已在欧盟、美国或日本获准上市的仿制药,经申报仿制药注册申请,由药审中心审评,批准上市后视为通过一致性评价。因此仿制药出口型的国内企业,在一致性评价进程中处于先发地位。
投资建议:
在关注注射剂一致性评价进展的基础上,可关注目前竞品相对较少、市场竞争缓和的独家品种。同时适当关注注射剂评价中进展较快和入选品种较多的个股。同时,仍可继续关注具有较强研发创新能力的行业个股。